Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
Elektrochemie: Redoxreaktionen sorgen für Spannung
Potentiometrie - NWE - galvanisches Element
1. Namen und Formeln
Aluminiumchlorid | | Wasserstoffoxid | |
Eisen(III)chlorid | | Calciumsulfat | |
Schwefelsäure | | Bariumchlorid | |
Propan | | Bariumhydroxid | |
Ethanol | | Lithiumhydroxid | |
Silbernitrat | | Acetation | |
Silberiodid | | Natriumoxid | |
2. Welche Ionen bilden die obigen Stoffe in wässriger Lösung?
3. Welche der obigen Stoffe sind Säuren, welche sind Basen?
4. Diese Aufgaben zur Potentiometrie muß jeder können:
Eine Konzentrationszelle besteht aus einer Kupferhalbzelle, in der c(Cu2+) = 0,1 mol/l ist und einer, in der die Konzentration der Kupferionen unbekannt ist. Die Zelle zeigt eine Spannung von 0,06 V, wobei die Vergleichshalbzelle den –Pol bildet.
a) Erläutere und begründe, wie die gemessene Spannung zustande kommt.
b) Berechne die Konzentration der Kupferionen. Beachte, welche Zelle den – Pol bildet!
Ein galvanisches Element besteht aus einer Silberhalbzelle. Hier ist die Konzentration 0,1 mol/l. Die zweite Halbzelle besteht aus einer Kupferhalbzelle. Diese bildet den negativen Pol. Die Spannung beträgt 0,6 V.
a) Erläutere und begründe, wie die gemessene Spannung zustande kommt.
b) Berechne die Konzentration der Kupferionen. Beachte, welche Zelle den – Pol bildet!
Ein galvanisches Element besteht aus einer Standardsilberhalbzelle. Man misst gegen eine Wasserstoffhalbzelle eine Spannung von 0,9 V. Diese bildet den - Pol.
a) Erläutere und begründe, wie die gemessene Spannung zustande kommt.
b) Berechne die Konzentration der Wasserstoffionen. Beachte, welche Zelle den – Pol bildet!
c) Welchen pH-Wert hat die Wasserstoffhalbzelle?
Ein galvanisches Element besteht aus einer Standardsilberhalbzelle. Man misst gegen eine Sauerstoffhalbzelle eine Spannung von 0,3 V, wobei die Silberhalbzelle den negativen Pol bildet.
a) Erläutere und begründe, wie die gemessene Spannung zustande kommt.
b) Berechne die Konzentration der Hydroxidionen. Beachte, welche Zelle den – Pol bildet!
c) Berechne den pH-Wert der Sauerstoffhalbzelle.
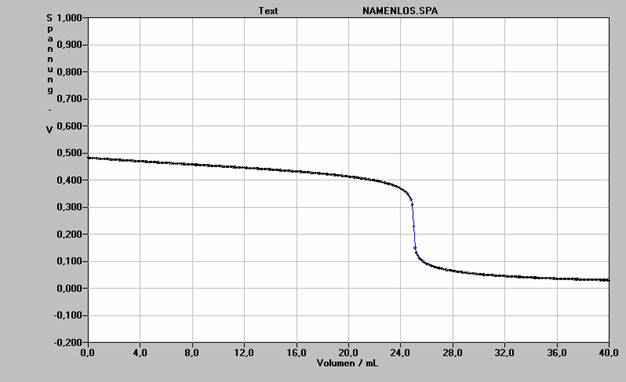
10 ml einer Natriumchloridlösung mit unbekannter Konzentration wird mit 0,1 mol/l Silbernitratlösung titriert. Man misst die Spannung in Abhängigkeit von der zugegebenen Menge Silbernitratlösung. Als Vergleichshalbzelle dient eine Silberhalbzelle, der Potential 0,741 V beträgt.
a) Wie groß ist c(Ag+) in der Vergleichshalbzelle? Ist dieser Wert wichtig für die Zielsetzung des Versuches? Begründe!
b) Wie groß ist die Konzentration der Chloridionen, die bestimmt werden soll?
c) Wie kommt die gemessene Spannung zustande?
d) Wie kommt es zu dem charakteristischen Kurvenverlauf?
Matthias Rinschen (C) 2006 - 2024, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung