 Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
Elektrochemie: Redoxreaktionen sorgen für Spannung
Salzsäure an Platinelektroden bei verschiedenen Konzentrationen, Löslichkeitsprodukt von Silberchlorid, Bromierung von Brombenzol
Aufgabe 1
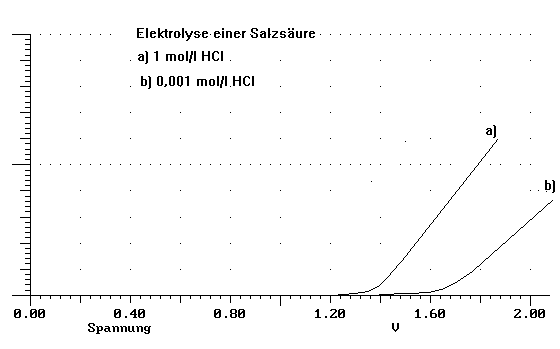
Elektrolyse einer Salzsäure an Platinelektroden bei verschiedenen Konzentrationen
Zur Untersuchung der Vorgänge bei der Elektrolyse einer Salzsäure an Platinelektroden nimmt man eine Strom/Spannungskurve für verschiedene Konzentrationen der Salzsäure auf.
Im ersten Versuch elektrolysiert man 1 mol/l HCl. Die Analyse der Produkte der Elektrolyse ergibt am +Pol die Entwicklung von Chlor, am - Pol die Entwicklung von Wasserstoff.
Im zweiten Versuch elektrolysiert man 0,001 mol/l HCl. Am - Pol entwickelt sich wieder Wasserstoff, am + Pol entwickelt sich ebenfalls ein Gas. Dieses ist aber nicht Chlor.
Die Aufnahme der Strom-Spannungskurve ergibt folgendes Bild:
- 2 -
a) Zeichnen Sie einen Versuchsaufbau zur Durchführung dieser Untersuchung und beschriften Sie die Zeichnung.
b) Beschreiben Sie die Aussage des Diagrammes.
c)Diskutieren Sie das Ergebnis von Versuch 1 in Hinblick auf die Vorgänge bei einer Elektrolyse und stellen Sie dar, welche der möglichen Elektrodenreaktionen ablaufen. Belegen Sie Ihre Überlegungen durch Berechnung der in Frage kommenden Elektrodenpotentiale.
d)Begründen und erläutern Sie für Versuch 1 den Verlauf der Strom-Spannungskurve.
e)Analysieren und interpretieren Sie insgesamt - auch in Zusammenhang mit Ihren vorhergehenden Darlegungen - das Ergebnis und die Beobachtungen zu Versuch 2.
Aufgabe 6
Potentiometrie
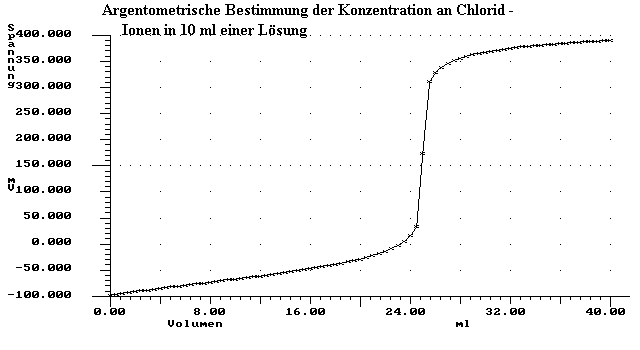
Zur Bestimmung der Konzentration an Chloridionen in einer Lösung baut man ein galvanisches Element auf, das aus einer Standard - Silberchlorid - Halbzelle besteht mit einer Konzentration von Cl- von 0,01 mol/l.. Die zweite Halbzelle enthält 10 ml der Lösung mit unbekannter Konzentration an Chloridionen. Diese titriert man mit 0,2 mol/l AgNO3 - Lösung.
Man nimmt folgenden Graphen auf:
- 3 -
a) Beschreiben Sie die Aussage des Graphen.
b) Bestimmen Sie den Äquivalenzpunkt und die Konzentration der vorgelegten Natriumchloridlösung.
c) Stellen Sie Aufbau und Funktionsweise der Silberchloridstandardelektrode dar und begründen Sie, warum deren Potential besonders stabil ist.
d) Berechnen Sie das Potential der hier gewählten Bezugselektrode (Silberchloridelektrode).
e) Begründen Sie den Verlauf der Kurve und erläutern Sie Methodik und Zielsetzung der Potentiometrie sowie ihre besonderen Vorteile.
f) Begründen Sie, welche Reaktionen an den Elektroden ablaufen, wenn die Spannung zwischen ihnen 0, -100 und +100 mV beträgt.
Aufgabe 3
Das Löslichkeitsprodukt von Silberiodid
Zur Bestimmung des Löslichkeitsproduktes von Silberchlorid wird folgende galvanische Zelle aufgebaut:
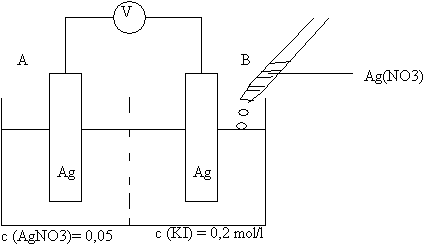
Man gibt zur Lösung A nur wenige Tropfen AgNO3. Sofort fällt gelbliches Silberbromid aus. Man mißt eine Spannung von 0, 825 V. Die Lösung B bildet den
- Pol.
a) Erläutern Sie die Funktionsweise der Versuchsanordnung.
b) Berechnen Sie das Löslichkeitsprodukt von Silberiodid. Erläutern Sie, wie Sie Ihren Lösungsweg bzw.wie Sie zu Ihren Ergebnissen kommen.
- 4 -
Aufgabe 4
Bromierung von Brombenzol
Gibt man zu Brombenzol Brom (Br2) so geschieht nichts. (Versuch 1) Gibt man jedoch zu Brombenzol Brom und Eisenbromid (FeBr3), so entfärbt sich das Reaktionsgemisch und Bromwasserstoff entweicht. (Versuch 2)
a)Beschreiben Sie den räumlichen Bau des B enzols und erläutern Sie die Besonderheiten des aromatischen Zustandes. Begründen Sie so den Verlauf von Versuch 1.
b) Formulieren Sie den Mechanismus der Reaktion von Brombenzol mit Brom bei Anwesenheit von Eisenbromid.
c) Erläutern Sie Mechanismus. Diskutieren Sie die Frage, welches Produkt bei dieser Reaktion entsteht.
- 5 -
Normalpotentiale
reduzierte Form oxidierte Form
Li Li+ +e- -3,03
Ca Ca2+ + 2e- -2,76
Na Na+ + e- -2,71
Al Al3+ +3e- -1,69
Zn Zn2+ + 2 e- -0.76
Fe Fe2+ + 2 e- -0,44
Pb Pb2+ + 2 e- -0,13
H2 + 2 H2O 2 H3O+ + 2 e- 0,00
Cu Cu2+ + 2e- +0,35
4 OH- O2 + 2 H2O + 4 e- +0,40
Fe2+ Fe3+ + e- +0,75
Ag Ag+ + e- +0,81
2 Cl - Cl2 + 2e- +1,36
Au Au3+ + 3e- +1,38
12 H2O + Mn2+ MnO4- + 8H3O+ + 5e- +1,50
2 SO42- S2O82- + 2e- +2,05
2 F- F2 + 2e- +2,85
ungefähre Überspannungen an Platinelektroden (in V)
Wasserstoff - 0,03
Sauerstoff +0,4
Chlor +0,008
Matthias Rinschen (C) 2006 - 2024, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung