 Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
Elektrochemie: Redoxreaktionen sorgen für Spannung
Die Wasserstoff - Sauerstoff Brennstoffzelle, Salzsäure an Platinelektroden bei verschiedenen Konzentrationen, Chlor-Alkali- Elektrolyse
Aufgabe 1
Elektrolyse einer Salzsäure an Platinelektroden bei verschiedenen Konzentrationen
Bei den Ihnen demonstrierten Experimenten werden folgende Chemikalien und Geräte verwendet: 1mol/l Salzsäure, 0,001 mol/l Salzsäure, Platinelektroden, Spannungsquelle, Meßgeräte
a)Zeichnen Sie den Versuchsaufbau sowie ein Diagramm zur Strom-Spannungskurve der durchgeführten Elektrolysen. Beschriften Sie Zeichnung und Diagramm.
b)Beschreiben Sie die Aussage der Diagramme und ihre Versuchsbeobachtungen.
c)Diskutieren Sie das Ergebnis von Versuch 1 in Hinblick auf die Vorgänge bei einer Elektrolyse und stellen Sie dar, welche der möglichen Elektrodenreaktionen ablaufen. Belegen Sie Ihre Überlegungen durch Berechnung der in Frage kommenden Elektrodenpotentiale.
d)Begründen und erläutern Sie für Versuch 1 den Verlauf der Strom-Spannungskurve.
e)Analysieren Sie insgesamt - auch in Zusammenhang mit Ihren vorhergehenden Darlegungen - das Ergebnis und die Beobachtungen zu Versuch 2.
Aufgabe 2
Chlor-Alkali-Elektrolyse
a) Analysieren Sie durch Berechnung der in Frage kommenden Potentiale, welche Produkte bei der Elektrolyse einer wäßrigen 1 mol/ NaCl an Platinelektroden zu erwarten sind.
b) Erläutern Sie, wie bzw. warum man bei der Chlor - Alkalielektrolyse nach dem Amalgam Verfahren besonders reine Produkte erhält.
c) Stellen Sie kurz die Bedeutung der Chlor - Alkalielektrolyse für die chemische Industrie dar.
Aufgabe 3
galvanische Elemente
a) Berechnen Sie folgende Potentiale und formulieren Sie die zugehörigen Redoxteilgleichungen:
Chlor in einer 0,5 mol/l NaCl - Lösung
Sauerstoff bei pH = 3
Wasserstoff bei pH = 12
b) Berechnen Sie die Konzentrationen folgender Halbzellen mit folgenden Potentialen:
Fe/Fe2+ -0,5 V
Cu/Cu2+ 0,3 V
c) Ein galvanisches Element ist aus einer Sauerstoffhalbzelle und einer Kupferhalbzelle aufgebaut. Die Kupferhalbzelle hat eine Konzentration von 0,5 mol/l und bildet den negativen Pol. Die Spannung der Halbzelle beträgt 0,2949 V. Wie groß ist der pH - Wert der Sauerstoffhalbzelle und welche Reaktionern laufen ab, wenn die Elektroden durch Drähte miteinander verbunden sind?
Aufgabe 5
Die Wasserstoff - Sauerstoff Brennstoffzelle
a) Skizzieren und erläutern Sie den prinzipiellen Aufbau der Wasserstoff - Sauerstoff - Brennstoffzelle, formulieren Sie die ablaufenden Elektrodenreaktionen und berechnen Sie die Spannung, die dieses Element liefert.
c) Welche besonderen Probleme sind derzeit mit der technischen Verwirklichung dieses Elementes verbunden? Welche besonderen Vorteile bietet dieses Element?
Aufgabe 6
Potentiometrie
Zur Bestimmung der Konzentration an Chloridionen in einer Lösung baut man ein galvanisches Element auf, das aus einer Standard - Silberchlorid - Halbzelle besteht mit einer Konzentration von Cl- von 0,01 mol/l.. Die zweite Halbzelle enthält 10 ml der Lösung mit unbekannter Konzentration an Chloridionen. Hierzu titriert man 0,2 mol/l AgNO3 - Lösung.
Man nimmt folgenden Graphen auf:
a) Beschreiben Sie die Aussage des Graphen.
b) Bestimmen Sie den Äquivalenzpunkt und die Konzentration der vorgelegten Natriumchloridlösung.
c) Zeichnen Sie den Aufbau der Silberchlorid - Standardelektrode und erläutern und begründen Sie deren besondere Bedeutung als Bezugselektrode.
d) Berechnen Sie das Potential der hier gewählten Bezugselektrode (Silberchloridelektrode).
e) Erläutern Sie Methodik und Zielsetzung der Potentiometrie sowie ihre besonderen Vorteile.
f) Begründen Sie, welche Reaktionen an den Elektroden ablaufen, wenn die Spannung 0, -100 und +100 mV beträgt.
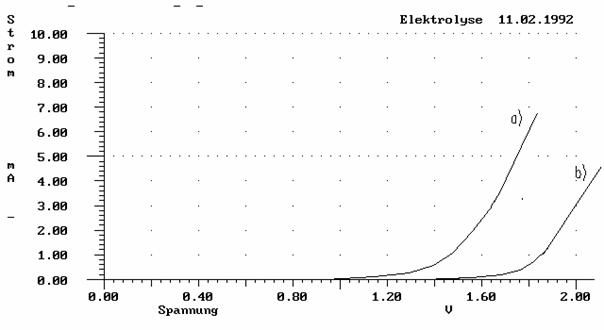
a) c(HCl) = 1 mol/l
b) c(HCl) = 0.0001 mol/l
a) c(HCl) = 1 mol/l
b) c(HCl) = 0.0001 mol/l
Lösung:1. Zersetzungsspannung HCl
1 m +Pol H2 0V
- Pol Cl2 1,36 V
O2 1,22 Vol/l
Uz = 1,56 wegen Überspannung
0,0001 Mol/l
-Pol H2 -0,236V
+Pol Cl2 1,59 V
O2 0,99 Volt
3. Chlor 1,377
O2 1,049
H2 - 0,708
b) cFe = 9,249 * 10 -3
c Cu = 0,02
c) E Cu = 0,34411
U = 0,636
pOH = 4
4. c Ag + = 10 -8
E = 0,338
Matthias Rinschen (C) 2006 - 2024, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung