 Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
Elektrochemie: Redoxreaktionen sorgen für Spannung
Elektrolyse einer Natriumchloridlösung (pH = 7) an Platinelektroden bei verschiedenen Konzentrationen, Potentiometrie, Bromierung von Brombenzol
Aufgabe 1
Elektrolyse einer Natriumchloridlösung (pH = 7) an Platinelektroden bei verschiedenen Konzentrationen
Bei dem Ihnen demonstrierten Versuch verwendet man folgende Chemikalien:
Versuch 1: 1 mol/l NaCl Lösung (pH=7)
Versuch 2: 0,0001 mol/l NaCl Lösung (pH=7)
Versuchsbeobachtungen, Wertetabellen
Versuch 1
V | 0 | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 | 1,2 | 1,4 | 1,6 | 1,7 | 1,8 | 1,9 | 2,0 | 2,1 | 2,2 |
mA | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,02 | 0,04 | 0,1 | 0,15 | 0,2 | 0,32 |
V | 2,3 | 2,4 | 2,6 | 2,8 | 3,0 | 3,2 | 3,4 | 3,6 | |||||||
mA | 0,42 | 0,52 | 0,74 | 0,98 | 1,2 | 1,4 | 1,6 | 1,82 |
Versuch 2
V | 0 | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 | 1,2 | 1,4 | 1,6 | 1,8 | 2,0 | 2,1 | 2,2 | 2,3 | 2,4 |
mA | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,02 | 0,05 | 0,08 | 0,14 | 0,18 |
V | 2,5 | 2,6 | 2,7 | 2,8 | 3,0 | 3,2 | 3,4 | 3,6 | 3,8 | 4,0 | |||||
mA | 0,24 | 0,30 | 0,38 | 0,42 | 0,56 | 0,7 | 0,82 | 0,95 | 1,1 | 1,2 |
Aufgaben
a)Beschreiben Sie die Versuche und Ihre Beobachtungen. Fertigen Sie eine Zeichnung des Versuchsaufbaus an.
b) Berechnen und diskutieren Sie die in Frage kommenden Potentiale für Versuch 1 und begründen Sie so, welche Reaktionen jeweils an den Elektroden abgelaufen sind.
c)Zeichnen Sie für beide Versuche ein Strom/Spannungsdiagramm, in dem Sie die in den beiden Versuchen gewonnenen Daten graphisch darstellen.
d) Beschreiben Sie die Aussage dieses Diagramms für beide Versuche.
e)Interpretieren Sie dieses Diagramm für die abgelaufenen Elektrodenreaktionen bei Versuch 1 und begründen Sie seinen Verlauf in Hinblick auf die allgemeinen Grundlagen der Vorgänge bei Elektrolysen.
f) Analysieren Sie das Diagramm sowie Ihre Beobachtungen zu Versuch 2 und interpretieren Sie die Ergebnisse. Begründen Sie, wie es zu den Unterschieden gegenüber Versuch 1 kommt.
Aufgabe 2
Potentiometrische Bestimmung der Konzentration von Chloridionen in einer wäßrigen Lösung
Zur Bestimmung der Konzentration an Chloridionen in einer Lösung baut man ein galvanisches Element auf, das aus einer Standard - Silberchlorid - Halbzelle besteht mit einer Konzentration von Cl- von 0,01 mol/l.. Die zweite Halbzelle enthält 20 ml der Lösung mit unbekannter Konzentration an Chloridionen. Hierzu titriert man
0,4 mol/l Silbernitratlösung - Lösung. Bei Zugabe der AgNO3-Lösung bildet sich in der zu analysierenden Lösung ein Niederschlag. (Lp(AgCl) = 10 -10)
Man nimmt folgenden Graphen auf:
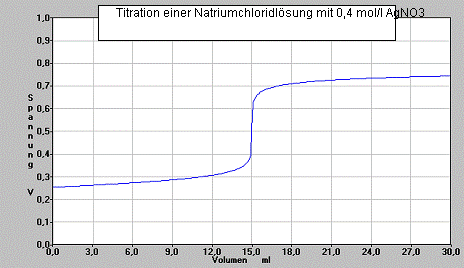 - 3 -
- 3 -
a) Beschreiben Sie die Aussage des Graphen.
b) Bestimmen Sie den Äquivalenzpunkt und die Konzentration der vorgelegten Natriumchloridlösung.
c) Zeichnen Sie den Aufbau der Silberchlorid - Standardelektrode und erläutern und begründen Sie deren besondere Bedeutung als Bezugselektrode. Berechnen Sie deren Potential.
d) Erläutern Sie das hier angewandte Verfahren der Potentiometrie und begründen Sie den Verlauf des Graphen.
Aufgabe 3
Bromierung von Brombenzol
Gibt man zu Brombenzol Brom (Br2) so geschieht nichts. (Versuch 1) Gibt man jedoch zu Brombenzol Brom und Eisenbromid (FeBr3), so entfärbt sich das Reaktionsgemisch und Bromwasserstoff entweicht. (Versuch 2)
a)Beschreiben Sie den räumlichen Bau des Brombenzols und erläutern Sie die Besonderheiten des aromatischen Zustandes. Begründen Sie so den Verlauf von Versuch 1.
b) Formulieren Sie den Mechanismus der Reaktion von Brombenzol mit Brom bei Anwesenheit von Eisenbromid.
c) Erläutern Sie Mechanismus. Diskutieren Sie die Frage, welches Produkt bei dieser Reaktion entsteht.
Normalpotentiale
reduzierte Form | oxidierte Form | Eo (V) |
Li | Li+ +e- | -3,03 |
Ca | Ca2+ + 2e- | -2,76 |
Na | Na+ + e- | -2,71 |
Al | Al3+ +3e- | -1,69 |
Zn | Zn2+ + 2 e- | -0.76 |
Fe | Fe2+ + 2 e- | -0,44 |
Pb | Pb2+ + 2 e- | -0,13 |
H2 + 2 H2O | 2 H3O+ + 2 e- | 0,00 |
Cu | Cu2+ + 2e- | +0,35 |
4 OH- | O2 + 2 H2O + 4 e- | +0, |
Fe2+ | Fe3+ + e- | +0,75 |
Ag | Ag+ + e- | +0,81 |
2 Cl - | Cl2 + 2e- | +1,36 |
Au | Au3+ + 3e- | +1,38 |
12 H2O + Mn2+ | MnO4- + 8H3O+ + 5e- | +1,50 |
2 SO42- | S2O82- + 2e- | +2,05 |
2 F- | F2 + 2e- | +2,85 |
Überspannungen in V an blanken Platinelektroden:
Wasserstoff | - 0,12 |
Sauerstoff | 0,72 |
: Chlor: | 0,006 |
Matthias Rinschen (C) 2006 - 2024, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung