Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
(titel
Kinetik und Massenwirkungsgesetz - wenn alles im Gleichgewicht ist ...
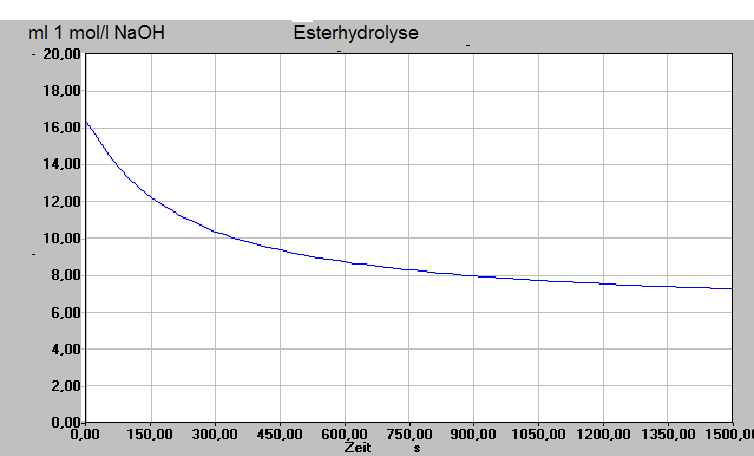
Reaktionskinetik und Massenwirkungsgesetz Name.................................................................... Aufgabe 1 Untersuchung der Reaktionsgeschwindigkeit der Reaktion von Magnesium mit Salzsäure (Schülerversuch) Machen Sie sich zu allen Versuchsbeobachtungen während der Versuche Notizen. Chemikalien: 3 cm Mg-Band (30 mg), 50 ml 0,8 mol/l HCl, Kupfersulfatlösung a) Stellen Sie die Temperatur der Salzsäure vor der Reaktion fest. b) Messen Sie die Zeit, die vergeht, bis die Salzsäure ein Stück Mg-Band aufgelöst hat. c) Erwärmen Sie 50 ml frische Salzsäure auf 30 °C und 40°C (wenn es mehr oder weniger ist, bitte den Wert notieren). Wiederholen Sie mit dieser Lösung den Versuch b) d) Rollen Sie das Stück Mg zusammen und wiederholen Sie damit den Versuch b) e) Fügen Sie zu der Lösung der Salzsäure 2-3 Tropfen Kupfersulfatlösung hinzu und wiederholen Sie mit dieser Lösung den Versuch b) Aufgaben: 1.1. Fertigen Sie ein genaues Versuchsprotokoll an. Schreiben Sie dazu auch die Reaktionsgleichung der Reaktion auf. 1.2. Definieren Sie den Begriff "Reaktionsgeschwindigkeit" und erläutern Sie das Verfahren, mit dem diese bei den durchgeführten Versuchen gemessen wird. 1.3. Zeigen Sie durch Berechnung der eingesetzten Stoffmengenkonzentrationen, daß das benutzte Verfahren bei den durchgeführten Versuchen anwendbar ist. 1.4. Werten Sie die Ergebnisse von Versuch b) und c) im Vergleich zueinander aus. Interpretieren und erklären Sie die gefundenen Werte und versuchen Sie ein Gesetz aufzustellen. Stellen Sie das Ergebnis auch graphisch dar. 1.5. Interpretieren Sie Versuch d) in Hinblick auf die Reaktionsgeschwindigkeit. 1.6. Interpretieren Sie Versuch e) in Hinblick auf die Reaktionsgeschwindigkeit. Aufgabe 2 Versuch: Untersuchung der Reaktion von Salzsäure mit Magnesium Zur Untersuchung der Kinetik der Reaktion von Salzsäure mit Magnesium bringt man jeweils eine kleine Menge Magnesium mit einem großen Überschuß Salzsäure zur Reaktion. Dabei wird in mehreren Versuchsreihen die Konzentration der Salzsäure variiert. Man nimmt jeweils eine Wertetabelle auf, indem man zu verschiedenen Zeitpunkten die jeweils gebildeten Volumina an Wasserstoff mißt. Zeit (s) 0,5 mol/l HCl 0,6 mol/l HCl 0,7 mol/l HCl 0,8 mol/l HCl 0,9 mol/l HCl 1,0 mol/l HCl 10 3,9 5,66 7,66 10,0 12,75 15,66 15 5,87 8,5 11,5 15,0 19,12 23,5 30 11,75 17,0 23,0 30,0 38,25 47,0 60 23,5 34,0 46,0 60,0 76,5 94,0 90 35,25 51,0 69,0 90,0 114,75 141,0 (angegeben ist die zu den jeweiligen Zeitpunkten bei entsprechenden Konzentrationen der Salzsäure gebildete Wasserstoff in ml) a)Zeichnen Sie die Menge des gebildeten Wasserstoffs in Abhängigkeit von der Zeit für die Konzentration von HCl = 0,5 bis 0,1 mol/l in ein Koordinatensystem. b) Beschreiben Sie das in a) gezeichnete Diagramm. c) Interpretieren Sie das in a) gezeichnete Diagramm in Hinblick auf den Begriff Reaktionsgeschwindigkeit und die Parameter, die diese hier bestimmen. d) Bestimmen Sie (graphisch oder rechnerisch) die Reaktionsgeschwindigkeiten bei den verschiedenen Konzentrationen der HCl und stellen Sie diese in Abhängigkeit von der Konzentration der HCl in einer Tabelle und graphisch dar. e) Bestimmen Sie das Geschwindigkeitsgesetz der Reaktion und geben Sie das Verfahren an, mit dessen Hilfe dieses Gesetz ermittelt wurde. Erläutern Sie die Aussage des Gesetzes. Aufgabe 3 Esterreaktion 29 ml Ethanol, 33 ml Aceton und 28 ml Essigsäure werden einige Stunden unter dem Rückflußkühler erhitzt. Man entnimmt in bestimmten Zeitabständen dem Reaktionsgemisch Proben von 3 ml, die man mit 1 mol/l NaOH titriert. Dichten: Essigsäure(CH3COOH) 1,05 g/ml Ethanol (C2H5OH) 0,789 g/ml Atommassen: H 1u, C 12u, O 16u Die aufgenommenen Daten werden in folgender Tabelle zusammengefaßt: Zeit (s) Verbrauch 1 mol/l NaOH Konzentration der HAc in der Lösung 0,00 16,32 20,00 15,67 40,00 14,93 60,00 14,28 80,00 13,73 100,00 13,24 140,00 12,42 180,00 11,77 220,00 11,22 260,00 10,78 300,00 10,38 340,00 10,05 400,00 9,65 460,00 9,31 520,00 9,03 620,00 8,65 680,00 8,47 740,00 8,30 820,00 8,13 900,00 7,96 980,00 7,83 1060,00 7,71 1140,00 7,60 1220,00 7,50 1300,00 7,43 1380,00 7,35 1460,00 7,29 1540,00 7,2 1800,00 7,2 Aufgaben a)Formulieren Sie die Reaktionsgleichung der abgelaufenen Reaktion und berechnen Sie die eingesetzten Konzentrationen von Essigsäure und Ethanol zu Beginn der Reaktion aus den eingesetzten Volumina. Erläutern Sie die Funktion des Acetons. b) Werten Sie die Tabelle aus und berechnen Sie dazu die jeweils aktuelle Konzentration der Essigsäure zum Zeitpunkt t. Geben Sie für t= 60 s die Konzentration aller in der Lösung vorhandenen Stoffe an. (kurze Rechnung) c) Zeichnen Sie ein Diagramm zur graphischen Darstellung Ihrer Berechnung von b) d) Beschreiben Sie den Graphen. e) Bestimmen Sie die Reaktionsgeschwindigkeit zum Zeitpunkt t = 20 und t = 1500 und begründen Sie die Unterschiede. f) Geben Sie eine allgmeine Interpretation des Graphen in Hinblick auf den Verlauf chemischer Reaktionen. Lösung Zeit (s) Verbrauch 1 mol/l 0,00 16,32 20,00 15,67 40,00 14,93 60,00 14,28 80,00 13,73 100,00 13,24 140,00 12,42 180,00 11,77 220,00 11,22 260,00 10,78 300,00 10,38 340,00 10,05 400,00 9,65 460,00 9,31 520,00 9,03 620,00 8,65 680,00 8,47 740,00 8,30 820,00 8,13 900,00 7,96 980,00 7,83 1060,00 7,71 1140,00 7,60 1220,00 7,50 1300,00 7,43 1380,00 7,35 1460,00 7,29 1540,00 7,2 1800,00 7,2 Nr. Zeit - s - 1 0,00 5,44 2 20,00 5,23 3 40,00 4,98 4 60,00 4,76 5 80,00 4,58 6 100,00 4,41 7 120,00 4,27 8 140,00 4,14 9 160,00 4,03 10 180,00 3,92 11 200,00 3,83 12 220,00 3,74 13 240,00 3,66 14 260,00 3,59 15 280,00 3,52 16 300,00 3,46 17 320,00 3,40 18 340,00 3,35 19 360,00 3,31 20 380,00 3,26 21 400,00 3,22 22 420,00 3,18 23 440,00 3,14 24 460,00 3,11 25 480,00 3,07 26 500,00 3,04 27 520,00 3,01 28 540,00 2,98 29 560,00 2,96 30 580,00 2,93 31 600,00 2,91 32 620,00 2,88 33 640,00 2,86 34 660,00 2,84 35 680,00 2,83 36 700,00 2,81 37 720,00 2,79 38 740,00 2,77 39 760,00 2,76 40 780,00 2,74 41 800,00 2,72 42 820,00 2,71 43 840,00 2,69 44 860,00 2,68 45 880,00 2,67 46 900,00 2,65 47 920,00 2,64 48 940,00 2,63 49 960,00 2,62 50 980,00 2,61 51 1000,00 2,60 52 1020,00 2,59 53 1040,00 2,58 54 1060,00 2,57 55 1080,00 2,56 56 1100,00 2,55 57 1120,00 2,55 58 1140,00 2,53 59 1160,00 2,53 60 1180,00 2,52 61 1200,00 2,51 62 1220,00 2,50 63 1240,00 2,50 64 1260,00 2,49 65 1280,00 2,48 66 1300,00 2,48 67 1320,00 2,47 68 1340,00 2,46 69 1360,00 2,46 70 1380,00 2,45 71 1400,00 2,44 72 1420,00 2,44 73 1440,00 2,44 74 1460,00 2,43 75 1480,00 2,43 76 1500,00 2,4
Matthias Rinschen (C) 2006 - 2024, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung