 Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
Kinetik und Massenwirkungsgesetz - wenn alles im Gleichgewicht ist ...
Titrationskurven - Puffer - pH-Werte
Aufgabe 1
Analyse einer wäßrigen Lösung
Jeweils 10 ml der wäßrigen Lösung eines Stoffes werden zur genaueren Untersuchung mit 1 mol/l Salzsäure titriert, wobei die Änderung des pH-Wertes in Abhängigkeit zur zugegegeben Salzsäure gemessen wird. Man erstellt folgendes Diagramme:
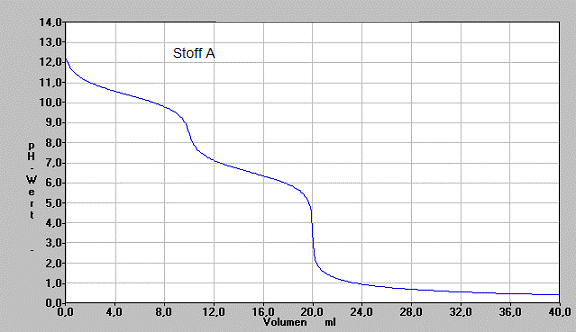
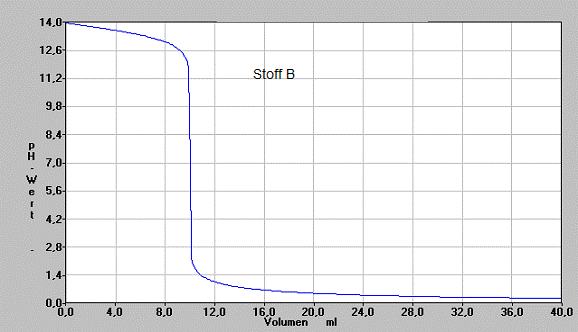
a) Beschreiben Sie vergleichend den Verlauf der Graphen
b) Analysieren Sie die Graphen und begründen deren Verlauf. Geben Sie dazu an und begründen Sie, wie die Lösung an bestimmten Punkten der Titration jeweils zusammengesetzt ist.
c) Stellen Sie alle Informationen zusammen, die man aus der gezeichneten Graphik über den titrierten Stoff erschließen kann. Geben Sie die Gesetze und Gesetzmäßigkeiten an, aus denen Sie diese Stoffeigenschaften folgern.
Aufgabe 2
Wäßrige Lösungen
Eine wichtige Frage ist es in der Chemie, ob eine Lösung in Wasser sauer, alkalisch oder neutral reagieren wird.
a) Erläutere die Begriffe sauer, alkalisch und neutral und definiere den pH-Wert.
b) Begründe aus dem Massenwirkungsgesetz, warum die Beziehung pH + pOH = 14 gilt. (Gleichgewichtskonstante für die Dissoziation von Wasser 3,2 * 10 -18)
c) Diskutiere die Frage, wie folgende Stoffe in Wasser reagieren:
Cl- HSO4- HCOO-
d) Versuch: Reaktion von NH4Ac bzw. NH4Cl in Wasser
Schwieriger als bei einfachen Ionen ist die Frage zu entscheiden, wie zusammengesetzte Stoffe, die in Wasser dissoziieren, reagieren. Klären Sie diese Frage mit Hilfe der Versuchs-beobachtung am Beispiel der Stoffe Ammoniumchlorid und Ammoniumacetat. Kann man hier eine Regel formulieren?
Aufgabe 3
Berechnung von pH-Werten
a)Zu 20 ml 0,1 mol/l Salzsäure werden 15 ml 0,05 mol/l NaOH gegeben. Berechnen Sie den pH -Wert der Lösung.
b)Welchen pH -Wert hat eine 0,7 mol/l Ammoniak - Lösung , die mit gleichkonzentrierter Salzäure titriert wird, am Äquivalenzpunkt?
c)Zu 50 ml einer 0,1 mol/l Lösung von Acetationen werden 0,05 g HCl gegeben. Berechnen Sie den pH-Wert der Lösung.
d) Zu 20 ml 0,2 mol/l Essigsäure gibt man 40 ml 0,2 mol/l NaOH.
e) Zu 20 ml 0,3 mol/l NH3 gibt man 10 ml 0,3 mol/l NH4+.
Aufgabe 3
Puffer
Geben ist ein System folgender Zusammensetzung: 20 ml einer Lösung, die 0,3 mol/l an HCOOH und 0,1 mol/l an HCOO- ist. Zu dieser Lösung gibt man 15 ml 0,1 mol/l NaOH. (Lösung A)
Ein anderes System, ebenfalls 20 ml, hat den gleichen pH-Wert wie das oben beschriebene. Hier wurde der pH-Wert durch Zugabe von Salzsäure erreicht. Auch zu dieser Lösung gibt man 15 ml 0,1 mol/l NaOH.
(Lösung B)
a) Erläutern Sie an den obigen Beispielen die Zusammensetzung und Wirkungsweise eines Puffers. Zeigen Sie die Unterschiede zwischen den Lösungen A und B auf und begründen Sie dadurch die Unterschiede bei der Zugabe von NaOH. Berechne alle pH-Werte (4).
b)Schlagen Sie einen Puffer für pH= 6,5 vor und berechnen Sie seine Zusammensetzung.
c)Warum kann eine Mischung aus Salzsäure und Kochsalz nicht als Puffer wirken?
d) Was wird in der "Henderson -Hasselbalch -Gleichung" vernachlässigt? Was berechtigt zu dieser Vernachlässigung?
Aufgabe 4
Berechnung der Titrationskurve einer Lösung des Ammonium-Ions mit NaOH.
Zur Darstellung der Änderung des pH-Wertes einer wäßrigen Lösung des Ammonium-Ions (z.B. Ammoniumchlorid) sollen folgende pH-Werte berechnet werden:
vorgelegte Mange NH4+-Lösung : 10 ml
Konzentration NH4+ : 0,2 mol/l
pH-Werte sollen berechnet werden für folgende zugegebenen Menge 0,1 mol/l NaOH:
0 ml 0,5 ml 1 ml 2ml 10 ml 19 ml 20 ml 21 ml 30 ml
a) Berechnen Sie den pH- Wert für die jeweils zugegebenen ml NaOH.
b) Zeichnen Sie eine Titrationskurve.
Lösung
Aufgabe 1
A zweiprotonig
schwache Base
pKs1, pKs2
c = 1 mol/l
b starke Base, c= 1mol/l
a) ANFANGSSTEIGUNG; Pufferbereich, Henderson - Hasselbalch Ä.P.
b)log. Funktion
Aufgabe 2
a) pH 0 - Log
b)........
c) stärkere Base als Base Wasser
d)starke Säure, starke Base..................
a) vorgelegt: 20 ml 0,1 mol/l Hcl 2 mmol
dazu 15 0,05 mol/l NaOH 0,75 mmol
er5gibt 35 ml 1,2 5 mmmol
c HCl = 0,035 pH = 1,44
b) 0,7 mol/l NH3 ÄP 0,35 mol/l NH4+
pH = 4,85
c) 50 ml 0,1 mol/l A- 5 mmol Ac-
0,05 g HCl = 1,369 mmol
c Ac- = 5 - 1,369 = 3,631
c HAc 1,369 pH = 5,17
d) 20 ml 0,2 mol/l HAc
40 ml 0,2 mol/l NaOH bleibt: 4 mmol OH- in 60 ml = 0,0666mol/l
pOH = 1,17
pH= 12,82
e) 20 ml 0,3 Mol/l NH3
10 ml 0,3 mol/l NH4+ pH = 9,55
Aufgabe 3
6 mmol HCOOH
2 mmol HCOO- pH = 3,2
+1,5 mmol OH-
4,5 mmol
3,5 mmol pH = 3,59
HCl pH = 3,2 = 6,3 *10 -4
in 20 ml 0,0126 mmol HCl
+ 1,5 OH-
bleibt: 1,487 mmol in 35 ml = 0,042 mol/l OH
pH = 12,62
b) Puffer pH = 6,5 Kohlensäure/Hydrogencarbonat
1: 0,95
c
d
Aufgabe 4
0 | 0,5 | 1 | 2 | 10 | 19 | 20 | 21 | 30 | |
0,05 | 0,1 | 0,2 | 1 | 1,9 | 2 | NH3 | |||
1,95 | 1,9 | 1,8 | 1 | 0,1 | NH4+ | ||||
4,96 | 7,658 | 7,95 | 8,3 | 9,25 | 10,52 | 11,03 | 11,51 | 12,39 | pH |
Matthias Rinschen (C) 2006 - 2024, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung