 Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
Kinetik und Massenwirkungsgesetz - wenn alles im Gleichgewicht ist ...
Klausuren
Thiosulfat - Est. - Zerfall NO
Hausaufgaben
Kinetik MWGLöslichkeitsproduktp
Vorschrift Esterrkt. mit Versuchsergebnissen
(navigation)
Titration Puffer - pH
Name.....................................................
Aufgabe1
Berechnung von pH -Werten
a) Berechne folgende pH - Werte:
o,o5 mol/l NaOH 0,0003 mol/l HCN 0,007 mol/l NH3
b)Welchen pH - Wert zeigen 20 ml einer 0,1 mol/l NaOH nach Zugabe von 3 ml 0,4 mol/l HCl?
c) Welchen pH - Wert zeigen 50 ml einer Lösung, in der 0,005 mol NH3 und 0,0004 mol NH4+ gelöst wurden?
Aufgabe 2
Protolysengleichgewichte in Wasser
Gegeben sind zwei Lösungen:
1. eine Salzsäure (HCl) mit der Konzentration 0,2 mol/l
2. eine Essigsäure (HAc) mit der Konzentration 0,2 mol/l.
a) Erläutern Sie an diesem Beispiel den Begriff "Säurestärke" und leiten Sie aus dem Massenwirkungsgesetz den Ks-Wert ab. Erläutern Sie die Aussage des Ks-Wertes.
b) Definieren Sie den Begriff "pH - Wert" und erläutern und begründen Sie aus dem Massenwirkungsgesetz, wie man die pH-Werte der gegebenen Lösungen berechnet. Begründen Sie vorgenommene Vereinfachungen. Führen Sie die Berechnung durch.
Aufgabe 3
Puffer
a) Eine Lösung von 100 ml enthält 0,2 mol/l HAc und 0,4 mol/l Ac-. Erläutern Sie die Vorgänge, die das Protolysengleichgewicht in dieser Lösung bestimmen und leiten Sie aus dem MWG ab, wie man den pH-Wert dieser Lösung berechnet.
b) Zu dieser Lösung gibt man 10 ml 0,2 mol/l HCl. Berechnen Sie den pH-Wert, den die Lösung jetzt hat.
Aufgabe 4
Titration einer Base mit 1 mol/l HCl
10 ml einer unbekannten Base A- werden mit 1 mol/l HCl titriert. Man nimmt den pH-Wert in Abhängigkeit von dem zugegebenen Volumen Salzsäure auf. Man erhält folgendes Diagramm:
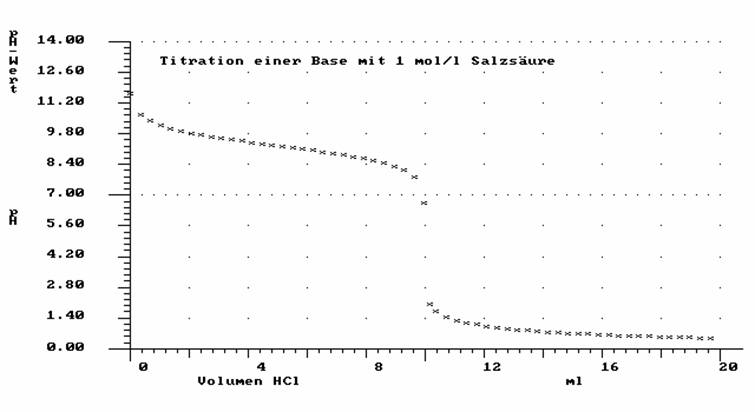
a) Beschreiben Sie das Diagramm.
b) Erklären Sie, welche Reaktion bei der Titration abläuft und in welcher Beziehung der Kurvenverlauf zur abgelaufenen Reaktion steht . (Definition pH-Wert)
c) Wurde eine starke oder schwache Base titriert? Kann man den Kb -Wert angeben? Beantworten Sie diese Fragen durch Diskussion des Kurvenverlaufs und Anwendung des Massenwirkungsgesetzes.
d) Bestimmen Sie den Äquivalenzpunkt graphisch, berechnen Sie die Konzentration der titrierten Base und berechnen Sie den pH-Wert am Äquivalenzpunkt.
e) Berechnen Sie den pH-Wert der Lösung nach Zugabe von 6 ml Salzsäure.
Falls Sie den Kb-Wert nicht bestimmen konnten. schätzen Sie ihn.
Säurekonstanten
Formel | pKs |
HCl | - 6 |
H2SO4 | -3 |
H3O+ | -1,74 |
HNO3 | -1,32 |
HSO4- | 1,92 |
H3PO4 | 1,96 |
HF | 3,14 |
HCOOH | 3,70 |
CH3COOH | 4,75 |
H2CO3 | 6,52 |
H2S | 6,92 |
H2PO4- | 7,12 |
NH4+ | 9,25 |
HCN | 9,40 |
HCO3- | 10,40 |
HPO42- | 12,32 |
HS- | 12,90 |
H2O | 15,74 |
NH3 | 23 |
Säuren und Basen
Man löst 0,1 mol HCl in 1 l wäßriger Lösung und beobachtet, daß der pH-Wert 1 beträgt. Löst man 0,1 mol HAc in 1 l wäßriger Lösung, beabachtet man, daß der pH-Wert 2,875 beträgt. Bei der Lösung von 0,1 mol NaOH in 1 l wäßriger Lösung beträgt der pH-Wert 13.
a) Geben Sie ein Verfahren zur Messung des pH-Wertes an und definieren Sie den pH-Wert.
b) Leiten Sie aus dem Massenwirkungsgesetz ab, welche Beziehung zwischen pH und pOH in wäßrigen Lösungen besteht.
c) Warum zeigen die beiden Säuren Salzsäure und Essigsäure bei gleicher Konzentration unterschiedliche pH-Werte? Definieren und erläutern Sie die zugrunde liegenden Gesetzmäßigkeiten unter Bezugnahme auf das Massenwirkungsgesetz.
d) Leiten Sie aus dem Massenwirkungsgesetz ab, wie man die pH-Werte der drei angegebenen Lösungen berechnet und erläutern und begründen Sie eventuell vorgenommene Vereinfachungen oder vereinfachende Annahmen.
Aufgabe2
Berechnung von pH - Werten
a)Berechne folgende pH - Werte:
0,3 mol/l HCl 0,04 mol/l NaOH 0,07 mol/l NH3
b) 0,1 g NaOH wurden in 150 ml NaOH gelöst. Welchen pH-Wert zeigt die Lösung?
c) Welchen pH-Wert zeigt die Lösung, die entsteht, wenn man zu 20 ml 0,1 mol/l HCl 12 ml 0,1 mol/l NaOH gibt.
Atommassen: Na 23 u
O 16 u
H 1 u
Aufgabe 3
Titrationskurven
20 ml einer Salzsäure wurden mit 0,1 mol/l NaOH titriert. Der pH-Wert wurde in Abhängigkeit von dem zugegeben Volumen NaOH gemessen. Man erhielt folgen Graphen:
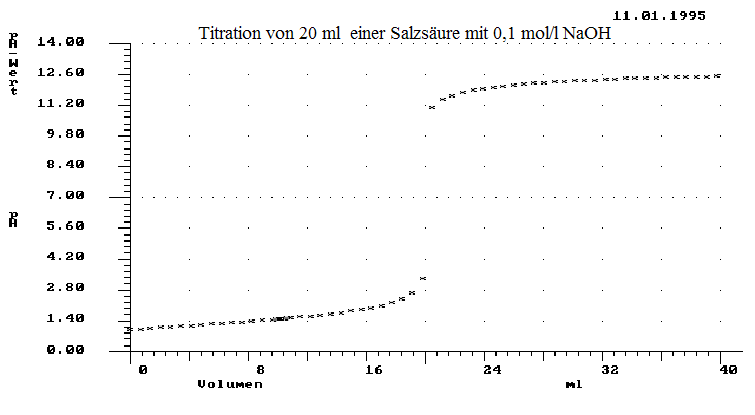
a) Beschreiben Sie den Verlauf des Graphen und bestimmen Sie den Äquivalenzpunkt.
b) Begründen Sie, welcher pH-Wert am Äquivalenzpunkt vorliegt.
c) Beschreiben Sie das Verfahren der Titration und erläutern Sie , welche Informationen der Chemiker dadurch erhält.
d) Berechnen Sie die Konzentration der titrierten Säure.
Lösungen:
a) Berechne folgende pH - Werte:
o,o5 mol/l NaOH 0,0003 mol/l HCN 0,007 mol/l NH3
12,6 6,4 10,5
b)Welchen pH - Wert zeigen 20 ml einer 0,1 mol/l NaOH nach Zugabe von 3 ml 0,4 mol/l HCl? 12,54
c) Welchen pH - Wert zeigen 50 ml einer Lösung, in der 0,005 mol NH3 und 0,0004 mol NH4+ gelöst wurden? 10,34
Aufgabe 2
Protolysengleichgewichte in Wasser
Gegeben sind zwei Lösungen:
1. eine Salzsäure (HCl) mit der Konzentration 0,2 mol/l 0,69
2. eine Essigsäure (HAc) mit der Konzentration 0,2 mol/l.2,72
a) Erläutern Sie an diesem Beispiel den Begriff "Säurestärke" und leiten Sie aus dem Massenwirkungsgesetz den Ks-Wert ab. Erläutern Sie die Aussage des Ks-Wertes.
b) Definieren Sie den Begriff "pH - Wert" und erläutern und begründen Sie aus dem Massenwirkungsgesetz, wie man die pH-Werte der gegebenen Lösungen berechnet. Begründen Sie vorgenommene Vereinfachungen. Führen Sie die Berechnung durch.
Aufgabe 3
Puffer
a) Eine Lösung von 100 ml enthält 0,2 mol/l HAc und 0,4 mol/l Ac-. Erläutern Sie die Vorgänge, die das Protolysengleichgewicht in dieser Lösung bestimmen und leiten Sie aus dem MWG ab, wie man den pH-Wert dieser Lösung berechnet.
5,05
b) Zu dieser Lösung gibt man 10 ml 0,2 mol/l HCl. Berechnen Sie den pH-Wert, den die Lösung jetzt hat.
4,98
Aufgabe 4e) pH= 9,07
Aufgabe 1
Matthias Rinschen (C) 2006 - 2024, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung