 Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
Protolysengleichgewichte: Wenn die Säure mit der Base ...
Puffer
Voraussetzung:
1. Berechnung von pH- Werten von allen Säuren und Basen.
2. Abschätzen, ob ein Stoff in Wasser sauer alkalisch oder neutral reagiert.
3. Den Taschenrechner bedienen.
4. Entscheiden, ob ein Stoff eine starke oder schwacheSäure oder Base ist.
5. Beschreiben, wie ein Puffer wirkt.
6. Begründen, warum eine Saltsäure mit pH=4 kein Puffer ist.
7. Puffer für bestimmte pH - Bereiche vorschlagen.
8. Die Zusammensetzung eines Puffer berechnen.
9. Titrationskurven beschreiben und interpretieren.
Aufgaben:
Folgende Titrationskurve wurde durch Titration mit 0,1 mol/l NaOH aufgenommen:
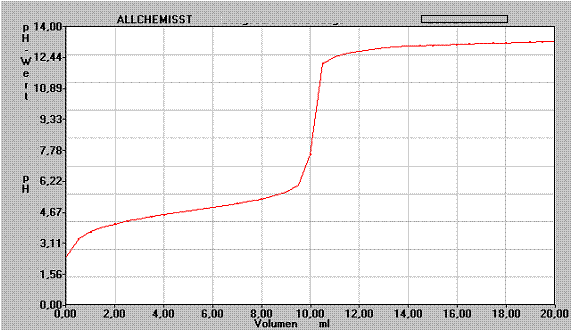
a) Beschreibe den Verlauf des Graphen.
b) Diskutiere die Frage, welche Stoffart hier titriert wurde und begründe den Verlauf des Graphen.
c) Kann man den Ks/Kb - Wert des titrierten Stoffes bestimmen? Begründe!
2. Hergestellt werden soll ein Puffer mit pH=7.
a) Erläutere und bergünde Zusammensetzung und Wirkungsweise eines Puffers.
b) Wähle ein Puffersystem aus und berechne seine Zusammensetzung für den gewünschten pH-Bereich.
c) Puffert die berechnete Lösung besser gegen Säure- oder Basenzugabe?
d) Setze die Konzentration der Säure des Puffers gleich 0,1 und berechne, welchen pH-Wert 20 ml der Lösung nach Zugabe von 5 ml 0,01 mol/l Salzsäure hat.
d) Welchen pH-Wert hätten 20 ml einer ungepufferten Lösung mit pH = 7 nach Zugabe der gleichen Säuremenge wie in d)?
Matthias Rinschen (C) 2006 - 2024, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung