 Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
Aufgabe mit Lösung: Organische Chemie
ElektrochemieOrganische Chemie
Übersicht org. Chemie Eigenschaften und Reaktionen des PhenolsEigenschaften und Reaktionen des Phenols
Eigenschaften und Reaktionen des AnilinsDarstellung und Weiterverarbeitung eines Kunststoffes
Eigenschaften und Reaktionen der Pikrinsäure
Pikrinsäure, Wasser, Natronlauge, Salzsäure, Wolle
Formel der Pikrinsäure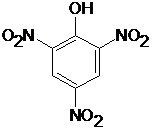
Aufgaben
a) Beschreiben Sie die Versuche und Ihre Beobachtungen.
b)Zur Diskussion der Säurefunktion der Pikrinsäure analysieren Sie Versuch 1 und 2. Zeigen Sie ausgehend vom Massenwirkungsgesetz, wie die Säurestärke definiert ist und begründen Sie so das Verhalten der Pikrinsäure gegenüber Wasser, Salzsäure und Natronlauge.
c) Geben Sie ein Verfahren an, mit dessen Hilfe man die Säurestärke der Pikrinsäure quantitativ bestimmen kann. Begründen Sie Ihre Darlegung aus der Theorie der Säuren und Basen bzw. dem Massenwirkungsgesetz. Schätzen Sie aus den Ergebnissen von Versuch 1 und 2 ab, in welcher Größenordnung sich die Säurestärke der Pikrinsäure bewegen wird.
b)Analysieren und begründen Sie die unterschiedliche Farbigkeit und Löslichkeit der Pikrinsäure in Versuch 1. Legen Sie dazu die Theorie der Farbstoffe nach dem Mesomeriemodell dar.
c) Legen Sie die Struktur der Wolle als Polypeptid grundsätzlich dar und interpretieren Sie davon ausgehend das Ergebnis von Versuch 2.
e)Zeigen Sie ausgehend von Phenol einen Weg zur Herstellung der Pikrinsäure auf. Formulieren Sie dazu den Reaktionsmechanismus in seinen wesentlichen Schritten.
Säurekonstanten
Formel | pKs |
HCl | - 6 |
H2SO4 | -3 |
H3O+ | -1,74 |
HNO3 | -1,32 |
HSO4- | 1,92 |
H3PO4 | 1,96 |
HF | 3,14 |
HCOOH | 3,70 |
CH3COOH | 4,75 |
H2CO3 | 6,52 |
H2S | 6,92 |
H2PO4- | 7,12 |
NH4+ | 9,25 |
HCN | 9,40 |
HCO3- | 10,40 |
HPO42- | 12,32 |
HS- | 12,90 |
H2O | 15,74 |
Beschreibung der Versuche
Versuch 1
Pikrinsäure wird in Wasser, Natronlauge und Salzsäure gegeben. In Wasser löst sich Pikrinsäure schlecht mit gelber Farbe, in Salzsäure löst es sich nicht. Eine Farbe tritt ebenfalls nicht auf. In Natronlauge löst es sich gut mit tiefgelber Farbe.
Versuch 2
Zu einer wässrigen Lösung von Pikrinsäure gibt man Salzsäure. Die gelbe Farbe verschwindet.
Versuch 3
Wolle wird von einer Lösung von Pikrinsäure dauerhaft gelb gefärbt.
Lösung
b) Beschreibung und Begründung der Säurefunktion von Pikrinsäure: Der – M-Effekt der Nitrogruppen erleichtert die Abspaltung des Protons an der OH-Gruppe durch die höhere Polarisierung, damit erklärt sich die gute Löslichkeit in Natronlauge durch die Bildung eines Salzes (Erleichterung der Protolyse durch die starke Base OH-). Durch die Zugabe der starken Säure HCl wird die Protolyse in wässriger Lösung zurückgedrängt, Pikrinsäure ist unlöslich, die gelbe Farbe verschwindet.
c)Definition des Ks - Wertes, Darstellung der Säure/Base Theorie und von Protolysengleichgewichten, Einordnung der Säure Pikrinsäure gegenüber Salzsäure: Pikrinsäure muß einen kleineren Ks-Wert haben als Salzsäure, da diese als stärkere Säure die Protolyse von Pikrinsäure zurückdrängt. Darstellung des Verfahrens zur Bestimmung des Ks - Wertes schwacher Säuren: Titration und Bestimmung des Halbtitrationspunktes, Begründung dieses Verfahrens aus dem MWG (Henderson Hasselbalch –Gleichung)
d) Der negativ geladene Sauerstoff des Pikrations hat einen stärkeren + M Effekt als die OH - Gruppe der Pikrinsäure: durch mesomere Grenzstrukturen kann aufgezeigt werden, daß die Delokalisierung der p - Elektronen des Pikrations auf Grund dieses Effektes wesentlich erleichtert ist. Das System der delokalisierten p - Elektronen wird dadurch größer und leichter anregbar (chinoide Struktur), dadurch Farbvertiefung; Halochromie: Theorie der Farbstoffe nach dem Mesomeriemodell
e) Darstellung eines Ausschnitts aus dem Makromoleküls der Wolle als Polypeptid mit sauren und basisch reagierenden Gruppen, Begründung des Färbeverfahrens als Reaktivfärbung mit Salzbildung auf der Faser.
f) Mechanismus der Nitrierung von Phenol
Matthias Rinschen (C) 2006 - 2024, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung