 Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
Aufgabe mit Lösung: Elektrochemie
Alle Aufgaben mit LösungElektrochemieOrganische Chemie
Übersicht - ElektrochemieElektrolyse einer O,1mol/l Kupfersulfat-lösung an Kupfer- und an Platinelektroden Elektrochemische Bestimmung des Löslichkeitsproduktes von Silberchlorid AgClVergleich der Elektrolyse von 1 mol/l Salzsäure und von 0,001 mol/l Salzsäure an Platin-elektroden
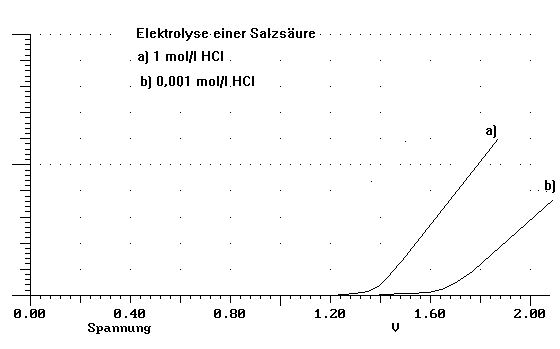
Zur Untersuchung der Vorgänge bei der Elektrolyse einer Salzsäure an Platinelektroden untersucht man die Abhängigkeit des Stromes (I) von der angelegten Spannung (U) bei verschiedenen Konzentrationen der Salzsäure auf.
Versuch 1
Im ersten Versuch elektrolysiert man 1 mol/l HCl. Die Analyse der Produkte der Elektrolyse ergibt am +Pol die Entwicklung von Chlor, am - Pol die Entwicklung von Wasserstoff.
Folgende Werte des Stromes in Abhängigkeit von der angelegten Spannung werden aufgenommen:
U(V) | 0 | 0,4 | 0,8 | 1,2 | 1,3 | 1,4 | 1,5 | 1,6 | 1,7 | 1,8 | 1,9 | ||
I(mA) | 0 | 0 | 0 | 0,015 | 0,02 | 0,04 | 0,32 | 0,58 | 0,78 | 0,98 | 1,18 |
Versuch 2
Im zweiten Versuch elektrolysiert man 0,001 mol/l HCl. Am - Pol entwickelt sich wieder Wasserstoff, am + Pol entwickelt sich ebenfalls ein Gas. Dieses ist aber nicht Chlor.
Folgende Werte des Stromes in Abhängigkeit von der angelegten Spannung werden aufgenommen:
U(V) | 0 | 0,4 | 0,8 | 1,2 | 1,3 | 1,4 | 1,5 | 1,6 | 1,7 | 1,8 | 1,9 | 2,0 | 2,1 |
I(mA) | 0 | 0 | 0 | 0 | 0,01 | 0,01 | 0,015 | 0,02 | 0,18 | 0,3 | 0,4 | 0,6 | 0,8 |
Aufgaben
a) Zeichnen Sie den Versuchsaufbau zur Durchführung dieser Untersuchung und beschriften Sie die Zeichnung.
b) Stellen Sie die gemessenen Werte graphisch dar und beschreiben Sie kurz die Aussage der Graphik.
c)Diskutieren Sie das Ergebnis von Versuch 1 in Hinblick auf die Vorgänge bei einer Elektrolyse und stellen Sie dar, welche der möglichen Elektrodenreaktionen ablaufen. Belegen Sie Ihre Überlegungen durch Berechnung der in Frage kommenden Elektrodenpotentiale.
d)Begründen und erläutern Sie für Versuch 1 den Verlauf der Strom-Spannungskurve.
e)Analysieren und interpretieren Sie insgesamt - auch in Zusammenhang mit Ihren vorhergehenden Darlegungen - das Ergebnis und die Beobachtungen zu Versuch 2.
| Normalpotentiale | ||
| reduzierte Form | oxidierte Form | Potential (V) |
| Li | Li+ + e- | -3,03 |
| Ca | Ca 2+ + 2 e- | -2,76 |
| Na | Na++ e- | -2,71 |
| Al | Al3+ +3 e- | -1,69 |
| Zn | Zn 2+ + 2 e- | -0.76 |
| Fe | Fe 2+ + 2 e- | -0,44 |
| Pb | Pb 2+ + 2 e- | -0,13 |
| H2 + 2 H2O | 2 H3O+ + 2 e- | 0,00 |
| Cu | Cu 2+ + 2 e- | +0,35 |
| 4 OH- | O2 + 2 H2O + 4 e- | +0,40 |
| Fe 2+ | Fe3+ + e- | +0,75 |
| Ag | Ag+ + e- | +0,81 |
| 2 Cl - | Cl2 + 2 e- | +1,36 |
| Au | Au3+ + 3 e- | +1,38 |
| 12 H2O + Mn 2+ | MnO4- + 8H3O+ + 5 e- | +1,50 |
| 2 SO42- | S2O82- + 2 e- | +2,05 |
| 2 F- | F2 + 2 e- | +2,85 |
| ungefähre Überspannungen an Platinelektroden (in V) | |
| Wasserstoff | - 0,03V |
| Sauerstoff | +0,4 V |
| Chlor | +0,008V |
Lösung
a)Zeichnung des Versuchsaufbaus für die Elektrolyse
b) Zeichnung der Strom/Spannungskurven für beide Elektrolysen, Beschreibung
c)Berechnung der Potentiale von
Wasserstoff: E(H 2+ 2H2O/2H3O+) = - 0,03 V,
Sauerstoff: E (4OH-/O2 + 2H2O) = + 1,626 V,
Chlor: E(2Cl -/Cl2) =1,368V
aus der Nernst'schen Gleichung und den gegebenen Verhältnissen. (angegebene Konzentrationen, angegebene Überspannungen): daraus Festlegung, welcher Stoff am - Pol reduziert (Wasserstoff) bzw. am + Pol oxidiert wird (Chlor). Bestimmung der Zersetzungsspannung der Elektrolyse (Uz=1,398V)
d) Anwendung und Erläuterung der Begriffe Lösungsdruck und Abscheidungsdruck auf die hier gegebenen Redoxpaare und die Verhältnisse bei der Elektrolyse, daraus abgeleitet Bildung eines galvanischen Elementes, dessen Elektronen sich entgegengesetzt zu denen der Spannungsquelle bewegen: Ein Strom kann somit zunächst nicht fließen. Daraus folgend Erklärung des Verlaufs der Stromspannungskurve.
e) Analyse und Darstellung der erfolgten Veränderung: Durch die Veränderung der Konzentrationen ergeben sich neue Potentiale für die in Frage kommenden Redoxpaare:
Wasserstoff: E(H2 +2H2O/2H3O+) = -0,207 V
Sauerstoff: E (4OH-/O2 + 2H2O) = 1,449 V
Chlor: E(2Cl -/Cl2) = 1,545 V
Daraus ergibt sich eine Veränderung der Verhältnisse am +Pol der Elektrolyse: auf Grund des negativeren Potentials wird hier jetzt Sauerstoff abgeschieden. Außerdem verändert sich natürlich insgesamt die Zersetzungsspannung (Uz=1,656V), wie man auch am Verlauf der Strom-Spannungskurve dieser Elektrolyse erkennen kann. (Bezug zur Strom/Spannungskurve
Matthias Rinschen (C) 2006 - 2024, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung