 Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
Aufgaben mit Lösung: Elektrochemie
Alle Aufgaben mit LösungElektrochemieOrganische Chemie
Übersicht - ElektrochemieElektrolyse einer O,1mol/l Kupfersulfat-lösung an Kupfer- und an Platinelektroden Elektrochemische Bestimmung des Löslichkeitsproduktes von Silberchlorid AgClPotentiometrische Titration einer Lösung mit verschiedenen Halogenidionen mit 0,1 mol/l Silbernitratlösung.
In einem Versuch zur potentiometrischen Bestimmung der Konzentration von Chloridionen und Bromidionen in einer Lösung wird folgendes galvanisches Element aufgebaut: Die Elektrode besteht in beiden Halbzellen aus Silber. Die Lösung in der ersten Halbzelle (Lösung A). ist eine 0,1 mol/l Silbernitratlösung Die zweite Halbzelle (Lösung B) enthält 100 ml einer Lösung mit einer unbekannten Konzentration von Chlorid- und von Bromidionen. Ein Diaphragma trennnt beide Lösungen
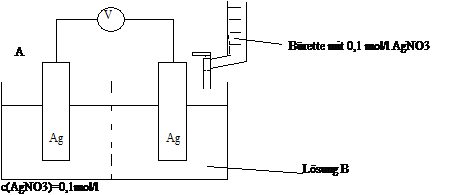
Die Spannung zwischen den beiden Elektroden wird gemessen, während man zur Lösung B schrittweise 0,1 mol/l Silbernitratlösung gibt. Während der Zugabe des Titers beobachtet man zunächst die Fällung von gelblichem Silberbromid, später fällt käsig - weißes Silberchlorid aus.
Die gemessenen Spannungen sind in der Tabelle auf Seite 4 wiedergegeben.
Aufgaben
a) Stellen Sie die Messwerte graphisch dar und beschreiben Sie die Aussage dieser Darstellung.
b)Erläutern und begründen Sie die Vorgänge, die zur Ausbildung der gemessenen Spannung führen.
c)Erörtern Sie, welche Reaktionen ablaufen, wenn man die Silbernitratlösung zu Lösung B zutitriert.
d)Diskutieren und erklären Sie ausgehend von Ihren Überlegungen in Aufgabe c) den Verlauf des aufgenommenen Graphen und erläutern Sie so das Verfahren der Potentiometrie.
e)Berechnen Sie die Konzentration an Chlorid - und an Bromidionen in Lösung B. Legen Sie abschließend dar, welche besonderen Vorteile das Verfahren der Potentiometrie bietet.
Löslichkeitsprodukte: | AgCl 10 –10 | AgBr 10 –13 |
Tabelle der bei der potentiometrischen Titration von 100 ml einer Lösung mit Bromid- und Chlorid – Ionen mit einer 0,1 mol/l AgNO3 – Lösung gemessenen Spannungen
ml 0,1 mol/l AgNO3 | Spannung (V) |
0 | 0,537 |
0,5 | 0,535 |
1,0 | 0,532 |
1,5 | 0,529 |
2,0 | 0,526 |
2,5 | 0,523 |
3,0 | 0,519 |
3,5 | 0,514 |
4,0 | 0,508 |
4,5 | 0,500 |
5,0 | 0,490 |
5,5 | 0,472 |
6,0 | 0,425 |
6,5 | 0,391 |
7,0 | 0,378 |
7,5 | 0,373 |
8,0 | 0,368 |
8,5 | 0,360 |
9,0 | 0,350 |
9,5 | 0,326 |
| |
ml 0,1 mol/l AgNO3 | Spannung (V) |
10,0 | 0,240 |
10,5 | 0,155 |
11,0 | 0,131 |
11,5 | 0,120 |
12,0 | 0,113 |
12,5 | 0,108 |
13,0 | 0,103 |
13,5 | 0,099 |
14,0 | 0,096 |
14,5 | 0,093 |
15,0 | 0,090 |
15,5 | 0,088 |
16,0 | 0,086 |
16,5 | 0,084 |
17,0 | 0,082 |
17,5 | 0,081 |
18,0 | 0,079 |
18,5 | 0,078 |
19,0 | 0,076 |
19,5 | 0,075 |
20,0 | 0,074 |
Lösung
a) Zeichnung des Graphen und Beschreibung seiner Aussage (Graph siehe unten)
b) Darstellung und Erläuterung der Elektrodenvorgänge, Ausbildung der elektrischen Doppelschicht, durch Lösungstension und Abscheidungstension der Metallionen, Entstehung der Potentialdifferenz aufgrund der unterschiedlichen Konzentrationen in den beiden Lösungen.
c) Formulierung und Erklärung der ablaufenden Reaktionen aufgrund der unterschiedlichen Löslichkeitprodukte von Silberchlorid und Silberbromid.
d) Bei Zugabe der Silbernitratlösung fällt zunächst AgBr aus. Wegen des kleineren Löslichkeitsproduktes dieser Substanz wird dadurch die Konzentration von Silberionen zu Beginn relativ klein und konstant gehalten, da diese sofort als Silberbromid ausfallen. Je näher man dem Äquivalenzpunkt kommt, desto stärker steigt die Konzentration von Silberionen bei Zugabe gleicher Mengen Silbernitrat aus der Bürette an. Die Konzentration an Bromidionen ist so klein geworden, daß eine immer größere Konzentration an Silberionen erforderlich ist, um eine weitere Fällung von Silberbromid zu erreichen. Schließlich ist deren Konzentration so groß geworden, daß die Fällung von Silberchlorid beginnt. Der Vorgang wiederholt sich. Entsprechend der größeren oder kleineren Konzentrationsänderung der Silberionen ändert sich die Spannung wie dargelegt.
e) Berechnung der Konzentration der Halogenidionen:
die Konzentration der Bromid - Ionen ist 0,006 mol/l , die der Chlorid Ionen 0,004 mol/l.
Besondere Vorteile des Verfahrens: mehrere Ionenarten können nebeneinander bestimmt werden, kein Indikator erforderlich , elektrische Aufnahme der Meßwerte
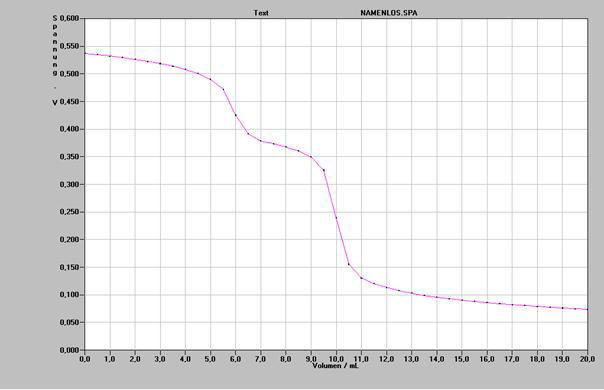
Graphische Darstellung der Messwerte der potentiometrischen Bestimmung
Matthias Rinschen (C) 2006 - 2024, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung