 Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
Aufgaben mit Lösung: Elektrochemie
Alle Aufgaben mit LösungElektrochemieOrganische Chemie
Übersicht - ElektrochemieElektrolyse einer O,1mol/l Kupfersulfat-lösung an Kupfer- und an Platinelektroden Elektrochemische Bestimmung des Löslichkeitsproduktes von Silberchlorid AgClElektrolyse einer Kupferchloridlösung an Platin- und an Kupferelektroden
Eine 0,1 mol/l CuCl2 Lösung wird an zwei Platinelektroden elektrolysiert. Man stellt an der negativen Elektrode die Abscheidung eines rötlichen Metalls, am positiven Pol die Entwicklung von Chlorgas fest.
(Versuch a)
In einem zweiten Versuch tauscht man die Platinelektroden gegen Kupferelektroden aus. man stellt fest, daß jetzt die Gasentwicklung ausbleibt. (Versuch b)
Zur genauen Untersuchung nimmt man die Strom/Spannungskurve der beiden Elektrolysen auf und erhält folgendes Diagramm:
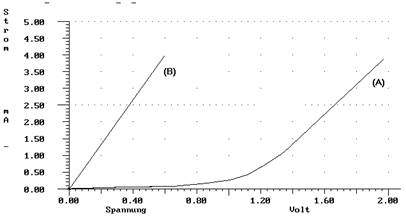
Elektrolyse einer Kupferchloridlösung an Kupfer- (B) und an Platinelektroden
Aufgaben
a)Zeichnen Sie den Aufbau der oben benutzten Elektrolyseapparatur und beschriften Sie die Zeichnung.
b)Berechnen Sie die Potentiale der bei der Elektrolyse an Platinelektoden möglichen Elektrodenvorgänge und begründen Sie daraus, warum die beschriebenen Reaktionen abalufen.
c)Beschreiben Sie den Verlauf der Strom/Spannungskurve für den Versuch a) und begründen Sie ihn, indem Sie die Vorgänge im atomaren Bereich darstellen, die bei dem Versuch an den Elektroden abalufen.
d) Analysieren Sie den Verlauf der Strom/Spannungskurve bei Versuch b, wobei Sie insbesondere die abgelaufenen Elektrodenvorgänge begründen sollten.
Normalpotentiale
reduzierte Form H2O Cu 4 OH- 2 Cl - | oxidierte Form 2 H3O+ + 2e- (pH = 0) Cu2+ + 2e- O2 + 2 H2O + 4e- (pH = 14) Cl2 + 2e- | Eo (V) 0 0,35 0,4 1,36 |
Überspannungen an Platinelektroden in V
Wasserstoff - 0,07
Sauerstoff + 0,7
Chlor + 0,08
Lösung
a)Zeichnung des Versuchsaufbaus der Elektrolyse
b)Berechnung der Potentiale von Wasserstoff ( - 0,427 V), Sauerstoff (+ 1,52 V), Chlor (1,418) und Kupfer (+ 0,35 V) aus der Nernst'schen Gleichung und den gegebenen Verhältnissen. (pH = 7, angegebene Überspannungen), daraus Festlegung, welcher Stoff am - Pol reduziert (Kupfer) bzw. am + Pol oxiert wird (Chlor). Bestimmung der Zersetzungsspannung der Elektrolyse
c) Anwendung und Erläuterung der Begriffe Lösungsdruck und Abscheidungsdruck auf die hier gegebenen Redoxpaare, daraus abgeleitet Bildung eines galvanischen Elementes, dessen elektrische "Wirkung" (EMK) der der Spannungsquelle entgegengesetzt ist.
d) Der Vorgang am - Pol ist die Umkehrung des Vorganges am + Pol, damit ist Zersetzungsspannung gleich Null: am + Pol wird Kupfer oxidert, am - Pol reduziert.
Matthias Rinschen (C) 2006 - 2024, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung