 Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
 Potentiometrische Bestimmung der Konzentration von Chloridionen in einer wäßrigen Lösung
Potentiometrische Bestimmung der Konzentration von Chloridionen in einer wäßrigen Lösung
Zur Bestimmung der Konzentration an Chloridionen in einer Lösung baut man ein galvanisches Element auf, das aus einer Standard - Silberchlorid - Halbzelle besteht mit einer Konzentration von Cl- von 0,01 mol/l.. Die zweite Halbzelle enthält 20 ml der Lösung mit unbekannter Konzentration an Chloridionen. Hierzu titriert man
0,4 mol/l Silbernitratlösung - Lösung. Bei Zugabe der AgNO3-Lösung bildet sich in der zu analysierenden Lösung ein Niederschlag. (Lp(AgCl) = 10 -10)
Man nimmt folgenden Graphen auf:
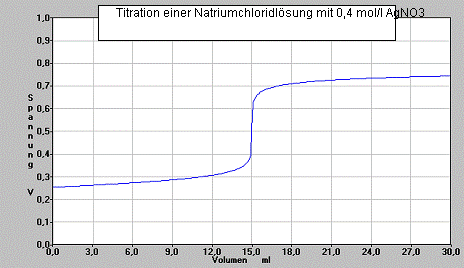
a) Beschreiben Sie die Aussage des Graphen.
b) Bestimmen Sie den Äquivalenzpunkt und die Konzentration der vorgelegten Natriumchloridlösung.
c) Zeichnen Sie den Aufbau der Silberchlorid - Standardelektrode und erläutern und begründen Sie deren besondere Bedeutung als Bezugselektrode. Berechnen Sie deren Potential.
d) Erläutern Sie das hier angewandte Verfahren der Potentiometrie und begründen Sie den Verlauf des Graphen.
Normalpotentiale
reduzierte Form oxidierte Form
Li Li+ +e- -3,03
Ca Ca2+ + 2e- -2,76
Na Na+ + e- -2,71
Al Al3+ +3e- -1,69
Zn Zn2+ + 2 e- -0.76
Fe Fe2+ + 2 e- -0,44
Pb Pb2+ + 2 e- -0,13
H2 + 2 H2O 2 H3O+ + 2 e- 0,00
Cu Cu2+ + 2e- +0,35
4 OH- O2 + 2 H2O + 4 e- +0,40
Fe2+ Fe3+ + e- +0,75
Ag Ag+ + e- +0,81
2 Cl - Cl2 + 2e- +1,36
Au Au3+ + 3e- +1,38
12 H2O + Mn2+ MnO4- + 8H3O+ + 5e- +1,50
Pb2+ + 6H2O PbO2 +4H3O+ + 2e- +1,46
2 SO42- S2O82- + 2e- +2,05
2 F- F2 + 2e- +2,85
ungefähre Überspannungen an Platinelektroden (in V)
Wasserstoff - 0,03
Sauerstoff +0,4
Chlor +0,008
Matthias Rinschen (C) 2006 - 2009, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung