 Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
 Potentiometrische Bestimmung der Konzentration von Chlorid-Ionen in einer Lösung.
Potentiometrische Bestimmung der Konzentration von Chlorid-Ionen in einer Lösung. (Vergleichshalbzelle: Silberhalbzelle)
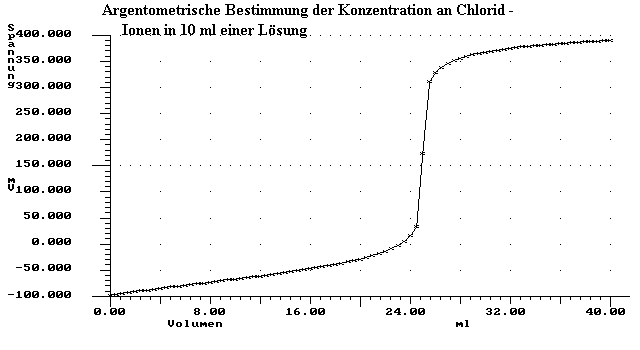
Zur Bestimmung der Konzentration an Chloridionen in einer Lösung baut man ein galvanisches Element auf, das aus einer Standard - Silberchlorid - Halbzelle besteht mit einer Konzentration von Cl- von 0,01 mol/l.. Die zweite Halbzelle enthält 10 ml der Lösung mit unbekannter Konzentration an Chloridionen. Diese titriert man mit 0,2 mol/l AgNO3 - Lösung.
Man nimmt folgenden Graphen auf:
- 3 -
a) Beschreiben Sie die Aussage des Graphen.
b) Bestimmen Sie den Äquivalenzpunkt und die Konzentration der vorgelegten Natriumchloridlösung.
c) Stellen Sie Aufbau und Funktionsweise der Silberchloridstandardelektrode dar und begründen Sie, warum deren Potential besonders stabil ist.
d) Berechnen Sie das Potential der hier gewählten Bezugselektrode (Silberchloridelektrode).
e) Begründen Sie den Verlauf der Kurve und erläutern Sie Methodik und Zielsetzung der Potentiometrie sowie ihre besonderen Vorteile.
f) Begründen Sie, welche Reaktionen an den Elektroden ablaufen, wenn die Spannung zwischen ihnen 0, -100 und +100 mV beträgt.
Normalpotentiale
reduzierte Form oxidierte Form
Li Li+ +e- -3,03
Ca Ca2+ + 2e- -2,76
Na Na+ + e- -2,71
Al Al3+ +3e- -1,69
Zn Zn2+ + 2 e- -0.76
Fe Fe2+ + 2 e- -0,44
Pb Pb2+ + 2 e- -0,13
H2 + 2 H2O 2 H3O+ + 2 e- 0,00
Cu Cu2+ + 2e- +0,35
4 OH- O2 + 2 H2O + 4 e- +0,40
Fe2+ Fe3+ + e- +0,75
Ag Ag+ + e- +0,81
2 Cl - Cl2 + 2e- +1,36
Au Au3+ + 3e- +1,38
12 H2O + Mn2+ MnO4- + 8H3O+ + 5e- +1,50
Pb2+ + 6H2O PbO2 +4H3O+ + 2e- +1,46
2 SO42- S2O82- + 2e- +2,05
2 F- F2 + 2e- +2,85
ungefähre Überspannungen an Platinelektroden (in V)
Wasserstoff - 0,03
Sauerstoff +0,4
Chlor +0,008
Matthias Rinschen (C) 2006 - 2009, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung