 Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
 Potentiometrie: Bestimmung der Konzentration der Sulfationen in einer Lösung
Potentiometrie: Bestimmung der Konzentration der Sulfationen in einer Lösung
Zur Bestimmung der SO42- - Ionen einer Lösung baut man folgende Apparatur auf:
Lösung A besteht aus einer gesättigten Lösung von Silberchlorid in 0,01 mol/l KCl, in die eine Silberelektrode taucht. (Lp (AgCl) =10-10)
Lösung B besteht aus 20 ml einer Lösung mit Pb 2+ Ionen unbekannter Konzentration, die hier bestimmt werden soll. In diese Lösung taucht eine Bleieelektrode. Beide Lösungen sind durch einen Stromschlüssel miteinander verbunden. Man mißt die Spannung zwischen beiden Elektroden.
Zu Lösung B wird jetzt schrittweise 0,5 mol/l K2SO4 - Lösung gegeben. Schwerlösliches Bleisulfat fällt aus. Man mißt die Spannung und trägt sie gegen das Volumen der zugegebenen Kaliumsulfatlösung auf.
Die Silberelektrode bildet den Pluspol.
Folgendes Diagramm wird aufgenommen:
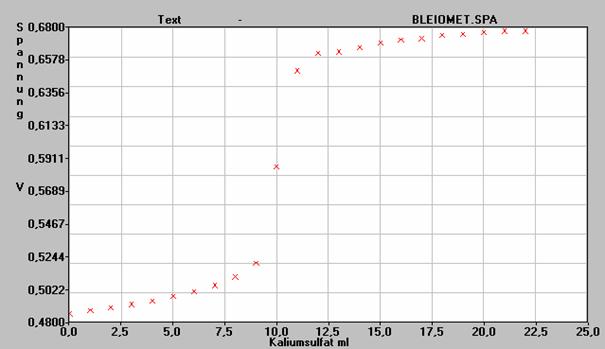
a)Zeichnen Sie den Versuchsaufbau.
b)Beschreiben Sie die Aussage des Diagramms und zeichnen Sie einen Graphen.
c)Erläutern Sie an dem hier vorgestellten Verfahren die Prinzipien der Potentiometrie und ihre besonderen Vorteile.
d)Begründen Sie den Verlauf des Graphen auch unter Bezugnahme Ihrer Erläuterungen in b) und c).
e)Bestimmen Sie die Konzentration der Bleiionen der Lösung.
f) Stellen Sie Aufbau und Funktionsweise der Silberchloridstandardelektrode dar und begründen Sie, warum deren Potential besonders stabil ist.
g) Berechnen Sie das Löslichkeitsprodukt von Bleisulfat. Bergründen Sie die einzelnen Rechenschritte.
Matthias Rinschen (C) 2006 - 2009, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung