 Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Chemieklausuren, Arbeitsblätter und mehr: www.deinchemielehrer.de
Aufgabensammlung für das Fach Chemie in der Schule
 Elektrolyse einer Salzsäure an Platinelektroden bei verschiedenen Konzentrationen
Elektrolyse einer Salzsäure an Platinelektroden bei verschiedenen Konzentrationen
Bei den Ihnen demonstrierten Experimenten werden folgende Chemikalien und Geräte verwendet: 1mol/l Salzsäure, 0,001 mol/l Salzsäure, Platinelektroden, Spannungsquelle, Meßgeräte
a)Zeichnen Sie den Versuchsaufbau sowie ein Diagramm zur Strom-Spannungskurve der durchgeführten Elektrolysen. Beschriften Sie Zeichnung und Diagramm.
b)Beschreiben Sie die Aussage der Diagramme und ihre Versuchsbeobachtungen.
c)Diskutieren Sie das Ergebnis von Versuch 1 in Hinblick auf die Vorgänge bei einer Elektrolyse und stellen Sie dar, welche der möglichen Elektrodenreaktionen ablaufen. Belegen Sie Ihre Überlegungen durch Berechnung der in Frage kommenden Elektrodenpotentiale.
d)Begründen und erläutern Sie für Versuch 1 den Verlauf der Strom-Spannungskurve.
e)Analysieren Sie insgesamt - auch in Zusammenhang mit Ihren vorhergehenden Darlegungen - das Ergebnis und die Beobachtungen zu Versuch 2.
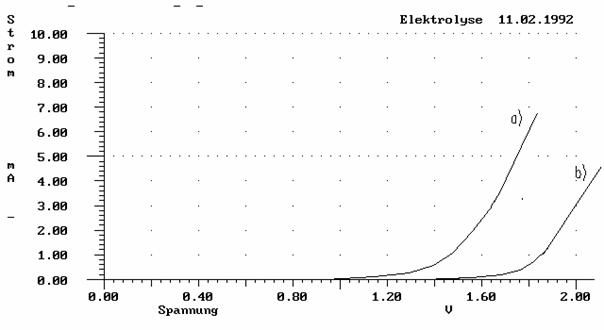
a) c(HCl) = 1 mol/l
b) c(HCl) = 0.0001 mol/l
Lösung:1. Zersetzungsspannung HCl 1 m
+Pol H2 0V
- Pol Cl2 1,36 V
O2 1,22 Vol/l
Uz = 1,56 wegen Überspannung
Zersetzungsspannung HCl 0,0001 Mol/l
-Pol H2 -0,236V
+Pol Cl2 1,59 V
O2 0,99 Volt
Matthias Rinschen (C) 2006 - 2009, Mail: deinchemielehrer [at] gmx [dot] de, Impressum und Datenschutzerklärung